Diferenciacion celular
Líneas de Investigación:
– Papel de SUMO en viabilidad celular y diferenciación
– Función de las proteínas BET en proliferación y diferenciación
Introducción
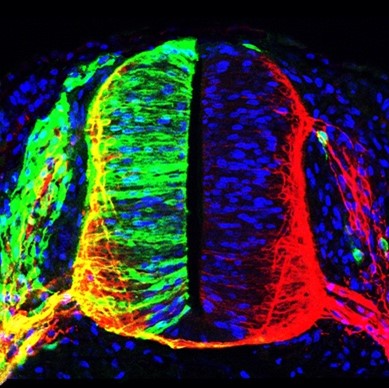 Hoy en día está claro que patologías humanas como el cáncer, las enfermedades degenerativas y los trastornos del desarrollo no tienen orígenes simples y comunes. La diversidad de factores que conducen a la alteración de la homeostasis en cada tipo de tejido requiere un análisis exhaustivo de las causas particulares que subyacen a una enfermedad concreta para poder aplicar de manera eficiente terapias de intervención adecuadas. Esto está estrechamente ligado a conceptos muy actuales como la medicina de precisión y personalizada. En este contexto, nuestro principal objetivo de investigación se centra en descifrar los mecanismos moleculares que controlan la viabilidad y diferenciación celular, especialmente en el sistema nervioso de vertebrados. En particular, estudiamos la modificación postraduccional de proteínas mediante la unión covalente del polipéptido SUMO (sumoilación), y también una familia de adaptadores de la cromatina, las proteínas BET, que están muy relacionados con cáncer. Estamos interesados en la señalización celular, el control transcripcional, y la estructura de la cromatina y factores asociados a ésta, para definir rutas y dianas nuevas y adecuadas para una intervención terapéutica precisa y eficaz.
Hoy en día está claro que patologías humanas como el cáncer, las enfermedades degenerativas y los trastornos del desarrollo no tienen orígenes simples y comunes. La diversidad de factores que conducen a la alteración de la homeostasis en cada tipo de tejido requiere un análisis exhaustivo de las causas particulares que subyacen a una enfermedad concreta para poder aplicar de manera eficiente terapias de intervención adecuadas. Esto está estrechamente ligado a conceptos muy actuales como la medicina de precisión y personalizada. En este contexto, nuestro principal objetivo de investigación se centra en descifrar los mecanismos moleculares que controlan la viabilidad y diferenciación celular, especialmente en el sistema nervioso de vertebrados. En particular, estudiamos la modificación postraduccional de proteínas mediante la unión covalente del polipéptido SUMO (sumoilación), y también una familia de adaptadores de la cromatina, las proteínas BET, que están muy relacionados con cáncer. Estamos interesados en la señalización celular, el control transcripcional, y la estructura de la cromatina y factores asociados a ésta, para definir rutas y dianas nuevas y adecuadas para una intervención terapéutica precisa y eficaz.
Papel de SUMO en viabilidad celular y diferenciación
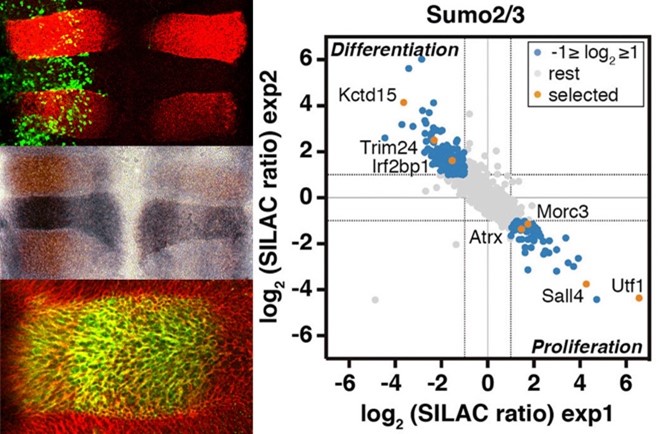 SUMO (Small Ubiquitin-like MOdifier) es un pequeño polipéptido, similar a la ubiquitina, capaz de unirse covalentemente a otras proteínas como modificador postraduccional. SUMO es esencial en eucariotas y participa en la regulación de casi todos los procesos celulares. La sumoilación está involucrada en el control transcripcional, el transporte nucleocitoplasmático, la estabilidad de proteínas y genomas y la modulación de la actividad enzimática. El proceso de modificación implica la transferencia de SUMO desde la enzima de conjugación UBC9 a la proteína diana, frecuentemente mediada por ligasas de SUMO, que favorecen y potencian la transferencia y son reguladores clave del proceso. Entre las ligasas de SUMO más estudiadas están las de la familia PIAS. Las proteasas específicas de SUMO de la familia SENP también son reguladores clave del proceso ya que escinden SUMO de las proteínas diana. Conocer en detalle las dianas de SUMO y los componentes de la ruta de sumoilación implicados en la regulación de la proliferación, diferenciación y viabilidad celular, así como los mecanismos reguladores asociados, resulta de gran interés terapéutico para enfermedades del desarrollo, del sistema nervioso y el cáncer. Hemos descubierto que el factor de transcripción KROX20 muestra actividad ligasa de SUMO sobre sus correpresores NAB durante el desarrollo del rombencéfalo. Hemos identificado la proteasa de SUMO SENP7 como un factor esencial para la neurogénesis y como protector de la viabilidad celular en células tumorales en condiciones limitantes de oxígeno y glucosa, siendo un marcador de pronóstico para el cáncer de colon. Mediante un estudio proteómico basado en la técnica SILAC, hemos identificado proteínas diferencialmente sumoiladas durante el proceso de neurogénesis. Entre ellas, hemos descrito como nueva diana de SUMO el factor de transcripción UTF1, cuya sumoilación regula su afinidad por la cromatina y el reclutamiento de la enzima de decapping DCP1A para el control transcripcional de genes bivalentes del desarrollo. En otro estudio proteómico hemos identificado más de cien proteínas sumoiladas en respuesta a ausencia de oxígeno y glucosa, condiciones asociadas a la isquemia y también frecuentes en el interior de tumores sólidos, y hemos estudiado cómo la sumoilación de factores específicos afecta a la viabilidad celular en estas condiciones deletéreas. Continuamos la investigación sobre dianas de SUMO y ligasas y proteasas con relación a varias patologías.
SUMO (Small Ubiquitin-like MOdifier) es un pequeño polipéptido, similar a la ubiquitina, capaz de unirse covalentemente a otras proteínas como modificador postraduccional. SUMO es esencial en eucariotas y participa en la regulación de casi todos los procesos celulares. La sumoilación está involucrada en el control transcripcional, el transporte nucleocitoplasmático, la estabilidad de proteínas y genomas y la modulación de la actividad enzimática. El proceso de modificación implica la transferencia de SUMO desde la enzima de conjugación UBC9 a la proteína diana, frecuentemente mediada por ligasas de SUMO, que favorecen y potencian la transferencia y son reguladores clave del proceso. Entre las ligasas de SUMO más estudiadas están las de la familia PIAS. Las proteasas específicas de SUMO de la familia SENP también son reguladores clave del proceso ya que escinden SUMO de las proteínas diana. Conocer en detalle las dianas de SUMO y los componentes de la ruta de sumoilación implicados en la regulación de la proliferación, diferenciación y viabilidad celular, así como los mecanismos reguladores asociados, resulta de gran interés terapéutico para enfermedades del desarrollo, del sistema nervioso y el cáncer. Hemos descubierto que el factor de transcripción KROX20 muestra actividad ligasa de SUMO sobre sus correpresores NAB durante el desarrollo del rombencéfalo. Hemos identificado la proteasa de SUMO SENP7 como un factor esencial para la neurogénesis y como protector de la viabilidad celular en células tumorales en condiciones limitantes de oxígeno y glucosa, siendo un marcador de pronóstico para el cáncer de colon. Mediante un estudio proteómico basado en la técnica SILAC, hemos identificado proteínas diferencialmente sumoiladas durante el proceso de neurogénesis. Entre ellas, hemos descrito como nueva diana de SUMO el factor de transcripción UTF1, cuya sumoilación regula su afinidad por la cromatina y el reclutamiento de la enzima de decapping DCP1A para el control transcripcional de genes bivalentes del desarrollo. En otro estudio proteómico hemos identificado más de cien proteínas sumoiladas en respuesta a ausencia de oxígeno y glucosa, condiciones asociadas a la isquemia y también frecuentes en el interior de tumores sólidos, y hemos estudiado cómo la sumoilación de factores específicos afecta a la viabilidad celular en estas condiciones deletéreas. Continuamos la investigación sobre dianas de SUMO y ligasas y proteasas con relación a varias patologías.
Función de las proteínas BET en proliferación y diferenciación
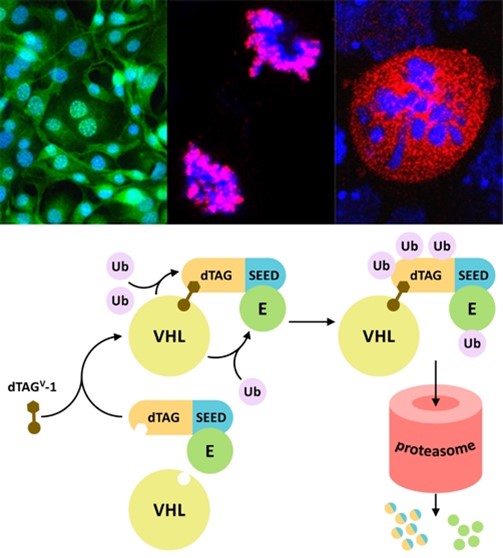 Las proteínas BET (BRD2, BRD3, BRD4 y BRDT) se caracterizan por la presencia de dos bromodominios capaces de reconocer histonas acetiladas en la cromatina y un dominio extraterminal (ET) exclusivo de esta familia. Estas proteínas son esenciales para el desarrollo, desempeñan un papel destacado en la progresión del ciclo celular, pero también en la diferenciación, y con frecuencia se encuentran desreguladas en la mayoría de los tipos de cáncer. Investigamos las proteínas BET en el contexto de la proliferación y la diferenciación celular, y en relación con la enfermedad. Nuestros resultados son de interés para el cáncer y otras enfermedades, en particular en lo que se refiere al descubrimiento de fármacos, la terapia celular y la medicina regenerativa. Hemos identificado un dominio de dimerización esencial en las proteínas BET y hemos descrito el antagonismo de pleiotrofina sobre BRD2 durante la neurogénesis. Hemos asignado un papel a la interacción LYAR-BRD2 en el control de la expresión del factor de pluripotencia Nanog tras inducir diferenciación. Hemos demostrado que NIPBL, el factor de carga de la cohesina asociado con el síndrome de Cornelia de Lange (CdLS), interacciona con el dominio ET de BRD4 para regular la expresión de genes del desarrollo, lo que explica por qué mutaciones en BRD4 muestran un fenotipo similar a CdLS. Recientemente, también hemos caracterizado la interacción de proteínas BET con la proteína de la envoltura (E) del virus SARS-CoV-2, abriendo nuevas vías de intervención terapéutica para combatir la enfermedad COVID-19. Así, nuestra investigación actual sobre proteínas BET está relacionada con diferentes patologías, como el cáncer, CdLS y la COVID-19, con especial interés en descubrir nuevos protocolos para la inhibición eficiente de proteínas BET.
Las proteínas BET (BRD2, BRD3, BRD4 y BRDT) se caracterizan por la presencia de dos bromodominios capaces de reconocer histonas acetiladas en la cromatina y un dominio extraterminal (ET) exclusivo de esta familia. Estas proteínas son esenciales para el desarrollo, desempeñan un papel destacado en la progresión del ciclo celular, pero también en la diferenciación, y con frecuencia se encuentran desreguladas en la mayoría de los tipos de cáncer. Investigamos las proteínas BET en el contexto de la proliferación y la diferenciación celular, y en relación con la enfermedad. Nuestros resultados son de interés para el cáncer y otras enfermedades, en particular en lo que se refiere al descubrimiento de fármacos, la terapia celular y la medicina regenerativa. Hemos identificado un dominio de dimerización esencial en las proteínas BET y hemos descrito el antagonismo de pleiotrofina sobre BRD2 durante la neurogénesis. Hemos asignado un papel a la interacción LYAR-BRD2 en el control de la expresión del factor de pluripotencia Nanog tras inducir diferenciación. Hemos demostrado que NIPBL, el factor de carga de la cohesina asociado con el síndrome de Cornelia de Lange (CdLS), interacciona con el dominio ET de BRD4 para regular la expresión de genes del desarrollo, lo que explica por qué mutaciones en BRD4 muestran un fenotipo similar a CdLS. Recientemente, también hemos caracterizado la interacción de proteínas BET con la proteína de la envoltura (E) del virus SARS-CoV-2, abriendo nuevas vías de intervención terapéutica para combatir la enfermedad COVID-19. Así, nuestra investigación actual sobre proteínas BET está relacionada con diferentes patologías, como el cáncer, CdLS y la COVID-19, con especial interés en descubrir nuevos protocolos para la inhibición eficiente de proteínas BET.
Financiación:
– AEI (PID, PGC)
– Junta de Andalucía
– CSIC
Lara-Ureña N, Gómez-Marín E, Pozuelo-Sánchez I, Reyes JC, García-Domínguez M (2024) SARS-CoV-2 E protein interacts with BRD2 and BRD4 SEED domains and alters transcription in a different way than BET inhibition. Cell Mol Life Sci 81: 313.
Samra N, Jansen NS, Morani I, Kakun RR, Zaid R, Paperna T, García-Domínguez M, Viner Y, Frankenthal H, Shinwell ES, Portnov I, Bakry D, Shalata A, Shapira Rootman M, Kidron D, Claessens LA, Wevers RA, Mandel H, Vertegaal ACO, Weiss K (2023) Exome sequencing links the SUMO protease SENP7 with fatal arthrogryposis multiplex congenita, early respiratory failure and neutropenia. J Med Genet 60: 1133-1141.
Gallardo-Chamizo F, Lara-Ureña N, Correa-Vázquez JF, Reyes JC, Gauthier BR, García-Domínguez M (2022) SENP7 overexpression protects cancer cells from oxygen and glucose deprivation and associated with poor prognosis in colon cancer. Genes Dis 9: 1419-1422.
Lara-Ureña N, Jafari V, García-Domínguez M (2022) Cancer-Associated Dysregulation of Sumo Regulators: Proteases and Ligases. Int J Mol Sci 23: 8012.
García-Gutiérrez P, García-Domínguez M (2021) SUMO control of nervous system development. Semin Cell Dev Biol 132: 203-212.
Correa-Vázquez JF, Juárez-Vicente F, García-Gutiérrez P, Barysch SV, Melchior F, García-Domínguez M (2021) The Sumo proteome of proliferating and neuronal-differentiating cells reveals Utf1 among key Sumo targets involved in neurogenesis. Cell Death Dis 12: 305.
Luna-Peláez N, March-Díaz R, Ceballos-Chávez M, Guerrero-Martínez JA, Grazioli P, García-Gutiérrez P, Vaccari T, Massa V, Reyes JC & García-Domínguez M (2019) The Cornelia de Lange Syndrome-associated factor NIPBL interacts with BRD4 ET domain for transcription control of a common set of genes. Cell Death Dis 10: 548.
Luna-Peláez N & García-Domínguez M (2018) Lyar-Mediated recruitment of Brd2 to the chromatin attenuates Nanog downregulation following induction of differentiation. J Mol Biol 430: 1084-1097.
Juárez-Vicente F, Luna-Peláez N & García-Domínguez M (2016) The Sumo protease Senp7 is required for proper neuronal differentiation. BBA Mol Cell Res 1863: 1490-1498.
García-Gutiérrez P, Juárez-Vicente F, Wolgemuth DJ & García-Domínguez M (2014) Pleiotrophin antagonizes Bromodomain-containing protein 2 (Brd2) during neuronal differentiation. J Cell Sci 127: 2554-2564.
Alfonso-Pérez T, Domínguez-Sánchez MS, García-Domínguez M & Reyes JC (2014) Cytoplasmic interaction of the tumor supresor protein hSNF5 with dynamin-2 controls endocitosis. Oncogene 33: 3064-3074.
Ceballos-Chávez M, Rivero S, García-Gutiérrez P, Rodríguez-Paredes M, García-Domínguez M, Bhattacharya SS & Reyes JC (2012) Control of neuronal differentiation by Braf35 sumoylation. Proc Natl Acad Sci USA 109: 8085-8090.
García-Gutiérrez P, Mundi M, & García-Domínguez M (2012) Association of bromodomain BET proteins to the chromatin requires dimerization through the conserved motif B. J Cell Sci 125: 3671–3680.
García-Gutiérrez P, Juárez-Vicente F, Gallardo-Chamizo F, Charnay P & García-Domínguez M (2011) The transcription factor Krox20 is an E3 ligase that sumoylates its Nab coregulators. EMBO Rep 12: 1018-23.








